Una font de corrent elèctric és un dispositiu amb el qual es crea un corrent elèctric en un circuit elèctric tancat. Actualment, s'han inventat un gran nombre de tipus d'aquestes fonts. Cada tipus s'utilitza per a finalitats específiques.
Contingut
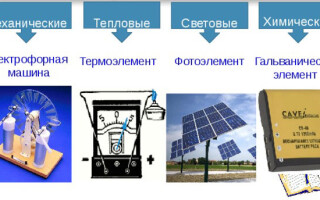
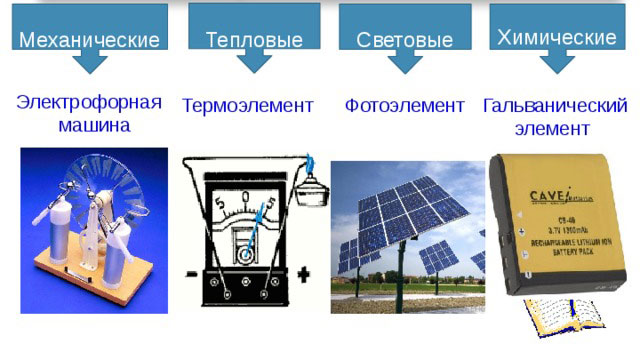
Tipus de fonts de corrent elèctric
Hi ha els següents tipus de fonts de corrent elèctric:
- mecànic;
- tèrmica;
- llum;
- química.
Fonts mecàniques
Aquestes fonts converteixen l'energia mecànica en energia elèctrica. La conversió es realitza en dispositius especials: generadors. Els principals generadors són els turbogeneradors, on la màquina elèctrica és accionada per un flux de gas o vapor, i els hidrogeneradors, que converteixen l'energia de l'aigua que cau en electricitat. La major part de l'electricitat de la Terra es produeix precisament per convertidors mecànics.

Fonts de calor
Aquí, l'energia tèrmica es converteix en electricitat. L'aparició d'un corrent elèctric es deu a la diferència de temperatura entre dos parells de metalls en contacte o semiconductors: termoparells. En aquest cas, les partícules carregades es transfereixen d'una zona calenta a una de freda. La magnitud del corrent depèn directament de la diferència de temperatura: com més gran és aquesta diferència, més gran és el corrent elèctric. Els termoparells basats en semiconductors donen una potència termoelèctrica 1000 vegades més gran que els bimetàl·lics, de manera que es poden fer fonts de corrent a partir d'ells. Els termoparells metàl·lics només s'utilitzen per mesurar la temperatura.

REFERÈNCIA! Per obtenir un termopar, heu de connectar 2 metalls diferents.
Actualment, s'han desenvolupat nous elements basats en la conversió de la calor alliberada durant la desintegració natural dels isòtops radioactius. Aquests elements s'anomenen generador termoelèctric de radioisòtops. A les naus espacials, un generador que utilitza l'isòtop del plutoni-238 ha demostrat ser bo. Dóna una potència de 470 W a una tensió de 30 V. Com que la vida mitjana d'aquest isòtop és de 87,7 anys, la vida del generador és molt llarga. Un termoparell bimetàl·lic s'utilitza per convertir la calor en electricitat.
fonts de llum
Amb el desenvolupament de la física dels semiconductors a finals del segle XX, van aparèixer noves fonts actuals: les bateries solars, en les quals l'energia de la llum es converteix en energia elèctrica. Utilitzen la propietat dels semiconductors per produir voltatge quan s'exposen a un flux de llum. Aquest efecte és especialment fort en els semiconductors de silici. Però tot i així, l'eficiència d'aquests elements no supera el 15%.Els panells solars s'han tornat indispensables a la indústria espacial i s'han començat a utilitzar en la vida quotidiana. El preu d'aquestes fonts d'alimentació disminueix constantment, però es manté força elevat: uns 100 rubles per 1 watt de potència.

Fonts químiques
Totes les fonts químiques es poden dividir en 3 grups:
- Galvànica
- Bateries
- Tèrmica
Les cèl·lules galvàniques funcionen a partir de la interacció de dos metalls diferents col·locats en un electròlit. Diversos elements químics i els seus compostos poden servir com a parells de metalls i electròlits. D'això depenen el tipus i les característiques de l'element.
IMPORTANT! Les cèl·lules galvàniques només s'utilitzen una vegada, és a dir. Un cop donats d'alta, no es poden restaurar.
Hi ha 3 tipus de fonts galvàniques (o bateries):
- sal;
- alcalí;
- Liti.
Les bateries de sal, o d'altra manera "seques", utilitzen un electròlit semblant a una pasta d'una sal d'un metall, col·locat en una tassa de zinc. El càtode és una vareta de grafit-manganès situada al centre de la copa. Els materials barats i la facilitat de fabricació d'aquestes bateries les van convertir en les més barates de totes. Però pel que fa a les característiques, són significativament inferiors als alcalins i de liti.

Les piles alcalines utilitzen una solució pastosa d'àlcali, hidròxid de potassi, com a electròlit. L'ànode de zinc es va substituir per zinc en pols, la qual cosa va permetre augmentar la sortida de corrent de l'element i el temps de funcionament. Aquests elements serveixen 1,5 vegades més que els de sal.
En una cèl·lula de liti, l'ànode està fet de liti, un metall alcalí, que augmenta considerablement la durada del funcionament. Però, al mateix temps, el preu va augmentar a causa del cost relativament elevat del liti. A més, una bateria de liti pot tenir una tensió diferent segons el material del càtode.Produeixen bateries amb una tensió d'1,5 V a 3,7 V.
Les bateries són fonts de corrent elèctric que poden estar sotmeses a molts cicles de càrrega-descàrrega. Els principals tipus de bateries són:
- Àcid de plom;
- ions de liti;
- Níquel-cadmi.
Les bateries de plom-àcid consisteixen en plaques de plom immerses en una solució d'àcid sulfúric. Quan es tanca un circuit elèctric extern, es produeix una reacció química, com a resultat de la qual el plom es converteix en sulfat de plom al càtode i ànode, i també es forma aigua. Durant la càrrega, el sulfat de plom a l'ànode es redueix a plom i al càtode a diòxid de plom.

REFERÈNCIA! Un element d'una bateria de plom-zinc genera una tensió de 2 V. En connectar els elements en sèrie, podeu obtenir qualsevol voltatge que sigui múltiple de 2. Per exemple, a les bateries d'automòbils, la tensió és de 12 V, perquè. connectats 6 elements.
La bateria d'ions de liti va rebre el seu nom pel fet que els ions de liti serveixen com a portador d'electricitat a l'electròlit. Els ions s'originen al càtode, que està fet de sal de liti sobre un substrat de paper d'alumini. L'ànode està fet de diversos materials: grafit, òxids de cobalt i altres compostos sobre un substrat de làmina de coure.
La tensió, segons els components utilitzats, pot ser de 3 V a 4,2 V. A causa de la baixa autodescàrrega i un gran nombre de cicles de càrrega-descàrrega, les bateries d'ions de liti s'han fet molt populars en els electrodomèstics.
IMPORTANT! Les bateries d'ió de liti són molt sensibles a la sobrecàrrega.Per tant, per carregar-los, cal utilitzar carregadors dissenyats només per a ells, que tenen circuits especials integrats que eviten la sobrecàrrega. En cas contrari, la bateria es podria destruir i s'encén.

A les bateries de níquel-cadmi, el càtode està fet de sal de níquel sobre una malla d'acer, l'ànode està fet de sal de cadmi sobre una malla d'acer i l'electròlit és una barreja d'hidròxid de liti i hidròxid de potassi. La tensió nominal d'aquesta bateria és d'1,37 V. Pot suportar entre 100 i 900 cicles de càrrega-descàrrega.
REFERÈNCIA! Les bateries de níquel-cadmi es poden emmagatzemar en estat descarregat, a diferència de les ions de liti.
Els elements químics tèrmics serveixen com a fonts d'energia de reserva. Ofereixen excel·lents característiques pel que fa a la densitat de corrent específica, però tenen una vida útil curta (fins a 1 hora). S'utilitzen principalment en tecnologia de coets, on es necessita fiabilitat i operació a curt termini.
IMPORTANT! Inicialment, les fonts químiques tèrmiques no poden produir un corrent elèctric. En ells, l'electròlit es troba en estat sòlid i per posar la bateria en condicions de funcionament, cal escalfar-se a 500-600 ° C. Aquest escalfament es realitza mitjançant una barreja pirotècnica especial, que s'encén en el moment adequat.
La diferència entre una font real i una ideal
Una font ideal, segons les lleis de la física, ha de tenir una resistència interna infinita per tal d'assegurar un corrent elèctric constant a la càrrega. Les fonts reals tenen una resistència interna finita, el que significa que el corrent depèn tant de la càrrega externa com de la resistència interna.
Aquí teniu un breu resum de la varietat de fonts modernes de corrent elèctric. Com es pot veure a la revisió, fins ara s'han creat un nombre impressionant de fonts amb característiques adequades per a qualsevol aplicació.
Articles semblants: